广州泛思生物竭诚为您服务
免疫显色试剂(双染Ⅰ型)说明书
科研货号:CSK1301
带证货号:SD8001
【产品名称】
通用名称:免疫显色试剂(双染Ⅰ型)
【包装规格】
机载:100~150测试/盒;手工:100~200测试/盒、300~600测试/盒
【预期用途】
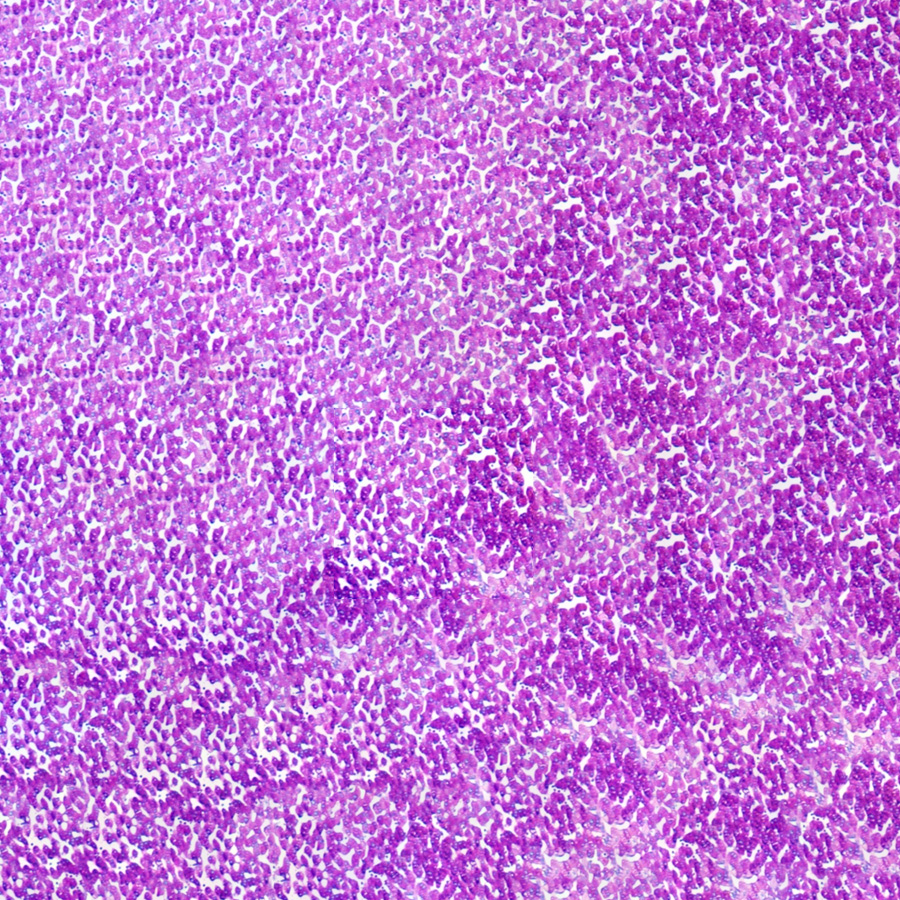
在免疫组化反应中与首要抗原抗体结合,通过染色,将靶点进行标记。
【检测原理】
利用抗体抗原特异性结合原理,并通过氧化还原反应使标记二抗的酶显色剂显色,对靶点进行定性定位。首先,鼠抗人抗体与靶点抗原Ⅰ结合,辣根过氧化物酶标记的鼠源性二抗与鼠抗人抗体结合,通过DAB染色液显色呈现棕色,对抗原Ⅰ进行定性定位。同时,兔抗人抗体与靶点抗原Ⅱ结合,碱性磷酸酶标记的兔源性二抗与兔抗人抗体结合,通过快红染色液显色呈现红色,对抗原Ⅱ进行定性定位。苏木素复染使组织结构更加清晰明了,利于病理医师的结果判读。
【主要组成成分】
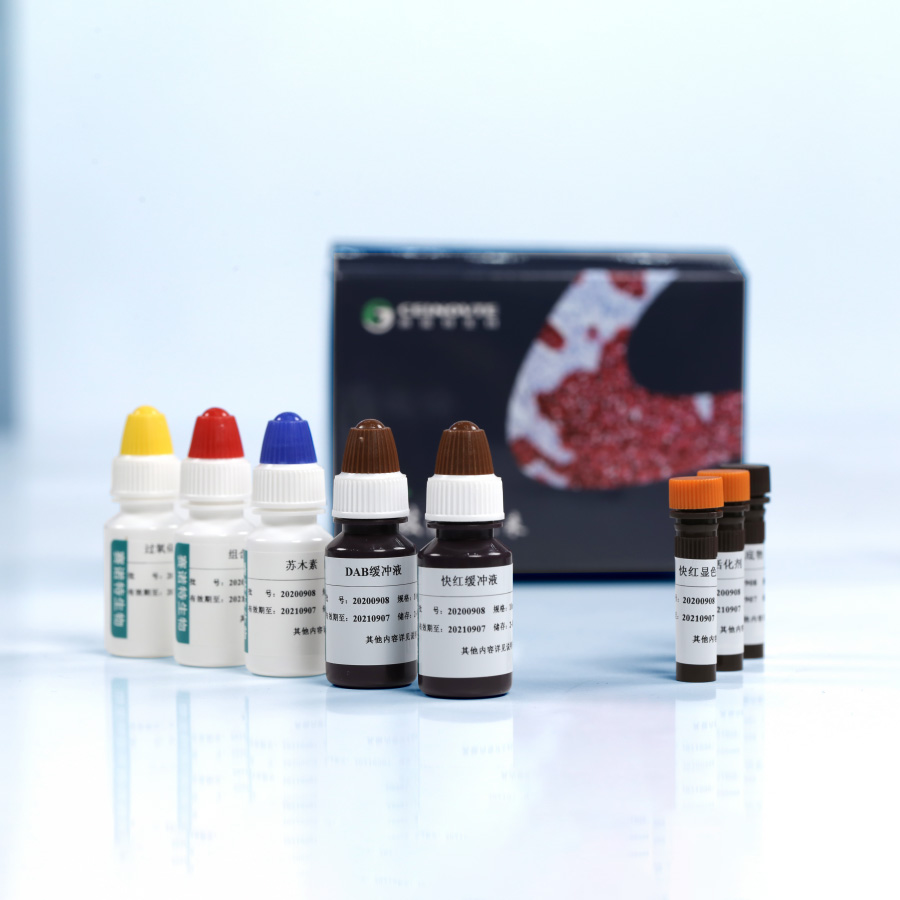
表1试剂盒主要组成成分
| 名称 | 包装规格 | 主要组成成分 | |||
| 100~150
测试/盒 |
100~200
测试/盒 |
300~600
测试/盒 |
|||
| 过氧化物酶封闭剂 | 15mL/瓶×1 | 10mL/瓶×1 | 30mL/瓶×1 | 过氧化氢、稳定剂Ⅰ | |
| 组合二抗(含辣根过氧化物酶标记的鼠源性二抗、碱性磷酸酶标记的兔源性二抗) | 15mL/瓶×1 | 10mL/瓶×1 | 30mL/瓶×1 | 辣根过氧化物酶标记的鼠源性二抗、碱性磷酸酶标记的兔源性二抗、蛋白保护剂、抑菌剂、稳定剂Ⅳ | |
| DAB底物 | 2mL/瓶×1 | 0.5mL/瓶×1 | 1.5mL/瓶×1 | 3,3′-二氨基联苯胺四盐酸盐水合物、三羟基甲基氨基甲烷(Tris)缓冲液、稳定剂Ⅱ | |
| DAB缓冲液 | 30mL/瓶×1 | 10mL/瓶×1 | 30mL/瓶×1 | 过氧化氢、Tris、显色剂、稳定剂Ⅲ | |
| 快红显色剂 | 2mL/瓶×1 | 0.4mL/瓶×1 | 1.2mL/瓶×1 | 快红色原 | |
| 活化剂 | 2mL/瓶×1 | 0.4mL/瓶×1 | 1.2mL/瓶×1 | 氧化剂Ⅰ | |
| 快红缓冲液 | 30mL/瓶×1 | 10mL/瓶×1 | 30mL/瓶×1 | 萘酚磷酸盐、 Tris | |
| 苏木素 | 15mL/瓶×1 | 10mL/瓶×1 | 30mL/瓶×1 | 苏木精、硫酸铝钾、氧化剂Ⅱ、稳定剂Ⅴ | |
| 试剂中不包含但对该项检测推荐使用的组分: 免疫组化抗原修复缓冲液(豫郑械备20180324号);浓缩清洗液(10×)(豫郑械备20140002号);抗体稀释液(豫郑械备20180260号);水性封片剂(货号 SD8008);抗体;二甲苯;乙醇(无水、95%、85%、70%);中性树胶;纯化水。
备注:即用型,不同批号试剂盒中各组分可以互换。 |
|||||
【储存条件及有效期】
2~8℃储存,避免冰冻。有效期为12个月。 开封后,采取即拿即用原则,每次使用后,应立即放回2~8℃冷藏冰箱中。 运输条件:运输温度不高于室温,运输时间不超过一周。 生产日期及使用期限详见标签。
【适用仪器】光学显微镜
【样本要求】
组织样本为新鲜活检或外科样本组织,10%中性缓冲福尔马林固定,固定时间为8~24h,参照病理技术规范要求取材、脱水、石蜡包埋并制成蜡块。
【检验方法】
提供手工试验操作方法供参考,机载试剂检验方法参照机器预设程序
1.检验所需仪器、设备
移液器、免疫组化油笔、计时器、孵育盒、染色架、盖玻片、光学显微镜、洗瓶。
2.溶液配制
DAB染色液:DAB底物和DAB缓冲液1:20比例配制所得。
快红染色液:快红显色剂、活化剂和快红缓冲液按照1: 1:30的比例配置所得,快红显色剂和活化剂混合反应3min之后,再加入快红缓冲液。
清洗液:采用浓缩清洗液和纯化水1:10比例配制所得。
3.试验温度条件:18~25℃
4.实验步骤
4.1脱蜡和水化
石蜡切片置于新鲜的二甲苯中,浸泡2次,10min/次;
除去多余的液体后,置于无水乙醇中,浸泡2次,5min/次;
除去多余的液体后,置于95%乙醇中,浸泡5min;
除去多余的液体后,置于85%乙醇中,浸泡5min;
自来水冲洗3次, 3min/次。
4.2抗原修复:高压锅沸腾修复3min,自然冷却,纯化水浸泡2次, 3min/次;清洗液浸泡1次,3min/次。抗原修复时,修复液的量必须保证切片始终能浸泡在液体内。
4.3加过氧化物酶封闭剂
将抗原修复后的切片用纯化水冲洗3次,3min/次,用油笔圈定玻片上的待测组织区域,清洗液冲洗1次,3min/次;
除去清洗液,在油笔圈定的区域内加过氧化物酶封闭剂(试剂量视切片大小,以完全覆盖切片组织为宜),室温下孵育5min;清洗液冲洗3次,3min/次。
4.4加抗体
除去清洗液,加入一抗(鼠抗)(试剂量视切片大小,以完全覆盖切片组织为宜),室温孵育60min; 清洗液冲洗3次,3min/次。
除去清洗液,加入一抗(兔抗)(试剂量视切片大小,以完全覆盖切片组织为宜),室温孵育60min; 清洗液冲洗3次,3min/次。
注:抗体的孵育顺序可以调整,优先孵育定位细胞核的项目。
4.5加组合二抗
除去清洗液,加入组合二抗(试剂量视切片大小,以完全覆盖切片组织为宜),室温孵育30min;清洗液冲洗3次,3min/次。
4.6 快红显色
除去清洗液,加入新鲜配制的快红染色液(试剂量视切片大小,以完全覆盖切片组织为宜),室温孵育5~10min, 纯化水冲洗3次,3min/次。
4.7 DAB显色
除去清洗液,加入新鲜配制的DAB染色液(试剂量视切片大小,以完全覆盖切片组织为宜),室温孵育5~10min, 纯化水冲洗3次,3min/次。
4.8复染
加苏木素(试剂量视切片大小,以完全覆盖切片组织为宜)孵育3min,纯化水冲洗返蓝。
4.9 水性封片剂封片
在玻片上样本区域滴加1滴水性封片剂进行封片,自然晾干或者65℃烤干,若需长期保存,干燥后再滴加中性树胶进行封片处理即可。
4.10 阅片:将封片后组织切片放置光学显微镜下观察结果。
- 质量控制
5.1 阳性对照
阳性对照可作为正确组织准备和适当染色技术的指示。每次染色都要包含同一测试条件下的阳性对照片进行比较。已知的阳性组织对照只能用于监控步骤的正确执行和试剂的测试,并不用于帮助叙述病人样本的明确诊断。如果阳性组织对照不能显示适当的阳性染色,此批实验测试样本的结果应认为是无效的。
5.2 空白对照
每次染色都要包含同一测试条件下的空白对照试剂进行对比。空白对照试剂来代替抗体对组织切片进行染色,用来判断非特异性着色,并对抗原部位特异性染色提供更好的解释。
【参考区间】
该试剂盒为染色试剂,无特定参考区间。
【检验结果的解释】
染色结果必须建立在阳性对照和空白对照实验成立的基础上:
阳性:显棕色或红色的位置为靶抗原部位;
阴性:无棕色或红色染色为非靶抗原部位;
结果解释应由资质的病理医生来判断。
【检验方法的局限性】
1.免疫组织化学病理诊断是一个多步的诊断过程,试剂选取、样本固定、处理、切片准备及染色结果解释等都必须经过严格的专业培训;经过认证的实验室和专业的操作人员将有助于实验检测过程的标准化,从而减少外界因素造成的染色偏差。
2.染色前组织的处理直接影响染色效果。不恰当的固定、冰冻、熔化、清洗、烘干、切片或被其他组织或液体污染都会造成假阳性、抗体定位不准确或假阴性结果。固定方法的不同或组织内部的不规则也可能造成异常的染色结果。
3.过度或不足的复染都会影响结果的正确解释。
4.任何阳性染色或阴性染色缺失的临床解释都必须参考其临床病史、细胞形态学和其他组织病理学背景进行评估。任何染色或其缺失的临床解释都必须以形态学研究和正确的对照及其他诊断试验作为补充。测试结果及诊断价值也应由病理医生结合临床及其他检查结果加以综合分析和判断。
5.由于肿瘤或其他病态组织中的抗原表达具有生物变异性,因此无法完全消除被测组织出现非预期反应的可能性。
6.假阳性的结果可能是由于蛋白或底物反应产物的非免疫学结合而造成的,也可能是红血球和细胞色素C所造成。
【产品性能指标】
- pH值:组合二抗和DAB缓冲液的pH值均为5~7.7。
- 符合性
取阳性对照及阴性对照,并做空白对照,按照说明书规定进行免疫组织化学检验,阳性对照染色结果为阳性,阳性着色的定位应准确,无背景着色;空白对照和阴性对照染色结果为阴性。
3.批内重复性
同一组织来源的组织切片染色强度和定位无明显差异。
4.批间重复性
不同批号试剂对同一组织来源的组织切片染色的强度和定位无明显差异。
【注意事项】
- 该试剂属于体外诊断试剂,不做其他用途。
- 实验开始前,应仔细阅读说明书。
- 该试剂必须是经过严格培训的专业人员在有效期内使用,如发现漏液、污染或变质,请勿使用。
- 若将该试剂中组份和其他公司的产品混合使用,可能会出现染色异常情况。
- 该试剂使用应采取适当的防护措施,避免试剂同皮肤和眼睛接触,禁止口吸试剂,若皮肤、粘膜等身体部位接触该试剂,及时使用大量水冲洗。
- 每次染色过程中,必须同时使用阳性对照片和空白对照试剂,否则结果不可采用。
- 抗原修复、孵育时间、温度条件或应用其他方法均可能导致错误结果。
- DAB有潜在致突变作用,在使用过程中应特别注意安全防护措施外,对其使用后的废液存放和去毒性处理也应符合相关法律法规要求。
【标识的解释】
| 符号 | 含义 | 符号 | 含义 | 符号 | 含义 |
| 产品货号 | 生产日期 | 储存温度 | |||
| 产品批号 | 有效期 | 其他详见说明书 |
【参考文献】
1.吴秉铨等《免疫组织化学病理诊断》.北京科学技术出版社,2007.3
2.国家食品药品监督管理局《体外诊断试剂说明书编写指导原则》2014.9.11
【基本信息】
备案人/生产企业名称:河南赛诺特生物技术有限公司
住所:郑州高新技术产业开发区翠竹街1号109号
联系方式:0371-56596916
售后服务单位名称:河南赛诺特生物技术有限公司
联系方式:0371-56596916
生产地址:郑州高新技术产业开发区玉兰街55号厂房F区
生产备案编号:豫郑食药监械生产备20140010号(更)
【医疗器械备案编号/产品技术要求编号】豫郑械备20200105号
【说明书批准日期】2020年04月23日
【说明书修改日期】第一次修改:2020年07月01日;
第二次修改:2021年11月29日;
第三次修改:2024年12月31日。
 泛思生物
泛思生物